嵌合抗原受体T细胞(Chimeric antigen receptor T cells, CAR-T)免疫治疗是利用基因工程技术修饰癌症病人自身的T细胞,使其获得肿瘤特异性识别及杀伤功能,以实现有效抗癌作用的一种新型免疫疗法。尽管CAR-T细胞在血液系统恶性肿瘤治疗领域取得了一定成就,然而在多数实体瘤中,由于存在复杂的免疫抑制机制,CAR-T细胞的治疗效果仍不理想。利用白介素等免疫调节性细胞因子如白介素-2、白介素-15等可显著的提升CAR-T细胞在肿瘤微环境中的增殖、存活和杀伤效果,但与此同时,相关细胞因子信号亦可能不当地激活机体免疫系统,使该疗法的安全性受到严峻挑战。因此,将促生长信号选择性地作用于CAR-T细胞成了领域内的难题之一。
近日,西安交通大学第二附属医院肿瘤病院张淑群教授团队联合北卡罗莱纳大学教堂山分校Gianpietro Dotti教授团队等,利用T细胞内源性白介素-23αp19亚基及白介素-23受体在激活后表达上调的特性,通过向T细胞转入白介素-12βp40亚基基因,开发出通过可控性分泌白介素-23而增强自身增殖、存活、杀伤能力的新型CAR-T细胞,并在多个实体瘤体内外模型中验证了该新型CAR-T细胞抑制肿瘤生长和复发的效果。值得一提的是,该新型CAR-T细胞分泌的白介素-23作用范围限制在激活后的T细胞,且优先结合于分泌白介素-23的T细胞自身,而局部环境中同样处于激活状态并表达白介素-23受体的“旁观者”T细胞上并无显著结合。由此证实肿瘤靶向性T细胞所分泌的白介素-23在体内作用位置及作用细胞选择的特异性,极大地减少了细胞因子系统性释放和作用的风险,使其应用的安全性得到进一步保障。
本研究描述了作用于CAR-T细胞新型的细胞因子系统p40/IL23。相比之前所有研究体系,p40/IL23细胞因子系统在抗癌功能上更加优秀,同时具有更高的安全性。此研究将开辟实体瘤的免疫治疗新领域,具有极高的临床应用价值,目前已申请相关专利,并积极进行临床试验前准备工作。
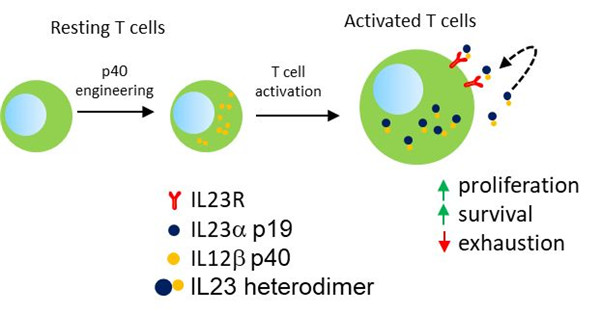
IL-23改造CAR-T细胞机制示意图
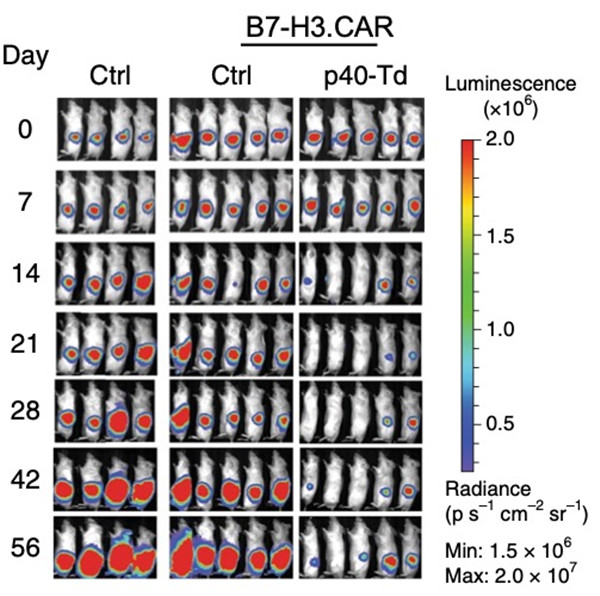
CAR-T细胞体内实验数据图
该项研究成果以“Interleukin-23 engineering improves CAR T cell function in solid tumors”(白介素-23相关基因改造促进CAR T细胞在实体瘤中的抗癌功能)为题发表在国际著名期刊Nature Biotechnology(自然生物科技)上(影响因子:31.864)。西安交通大学第二附属医院肿瘤病院马兴聪博士为该论文的第一作者,西安交通大学第二附属医院为第一作者的共同署名单位。北卡罗莱纳大学教堂山分校Lineberger综合癌症中心Gianpietro Dotti教授及许扬博士为共同通讯作者。
张淑群教授团队近年来注重国际科研合作,积极与国外著名研究机构进行博士研究生的联合培养,提高团队学术视野和科研水平,提升科研能力,促进科室整体水平提升。团队中赵茜茜博士曾于德州大学MD安德森癌症中心副校长洪明奇教授实验室学习,获得实验室所有成员的一致好评,留院当年成功申请国家自然科学基金,并发表数篇高水平论文。
文章链接:https://www.nature.com/articles/s41587-019-0398-2